金属-テトラピロール補酵素を生合成する酵素の基質選別の仕組みを理解し、その仕組みを変えた人工酵素を用いて非天然型のニッケル補酵素を創る!(大学院理工学研究科 藤城貴史教授)
2024/11/21
- プレスリリース全文はこちらからご覧ください。
概要
埼玉大学の藤城貴史教授の研究グループは、ヘムやビタミンB12などの「金属-テトラピロール」補因子群の生合成酵素「キラターゼ」の祖先型と知られるCfbAが、その活性部位の11番目のセリン(Ser11)の周辺で、基質テトラピロールを選別する仕組みを、X線結晶構造解析により明らかとしました。また、Ser11を別のアミノ酸であるトレオニン(Thr)に置換したCfbA変異型酵素は、野性型CfbAでは利用できない非天然のテトラピロールを基質として利用できるようになることを見出し、この人工の変異型酵素を用いて非天然型ニッケル補酵素を作ることに成功しました。
本研究は、生命に必須の「金属-テトラピロール補因子群」と、CfbAを含めた「II型キラターゼ酵素群」の補因子-酵素の共進化プロセスの検証を可能とすると共に、この知見を生かした様々な人工金属補因子を合成する酵素触媒システムの構築において、分子レベルでの設計指針を提供します。
本成果は、タンパク質科学の最大の国際学術団体であるThe Protein Societyの機関紙『Protein Science』に、オンライン速報版として2024年11月15日に公開されました。
(URL: https://onlinelibrary.wiley.com/doi/10.1002/pro.5208)
ポイント
- CfbAはニッケル-テトラピロール補酵素F430の生合成系で金属錯体構造を作る酵素であり、ニッケル、鉄、コバルトなどの利用が知られる「金属-テトラピロール」補因子群の生合成酵素「II型キラターゼ生合成酵素ファミリー」の祖先型として知られる。
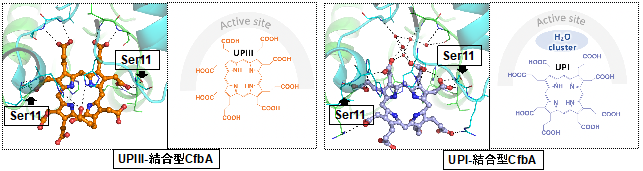
- 今回、天然の基質に類似し、基質となるUPIII、基質とならないUPIとCfbAとの複合体のX線結晶構造解析により、CfbAの基質選別機構を調べた。
- その結果、CfbAの活性部位のSer11周辺構造がもたらす親水性相互作用により、UPIII、UPIがそれぞれ異なる配置でCfbAに結合することを見出した(図1)。
- さらに、Ser11をThrに人工的に変異させたCfbA変異型酵素は、野生型が基質として利用しないCPIを利用できることを見出した。
- 本研究で得られた知見は、この祖先型CfbAを進化の起点とした、他のテトラピロール補因子とキラターゼ酵素の共進化過程の検証や、新たな人工金属補因子合成のための酵素触媒系の構築に役立つと期待される。
論文情報
| 掲載誌 | Protein Science |
|---|---|
| 論文名 | Structural insights into the recognition of tetrapyrrole substrates by ancestral class II chelatase CfbA |
| 著者名 | Shoko Ogawa, Masahide Hikita, Takashi Fujishiro |
| DOI | 10.1002/pro.5208 |
| URL | https://doi.org/10.1002/pro.5208 |
用語解説
(a)金属-テトラピロール補因子群: 4つのピロールが連結して環状になり、その中央の穴に金属イオンが結合して金属錯体となった構造を持つ補因子の総称。鉄を含むヘムや、コバルトを含むビタミンB12、マグネシウムを含む葉緑体の緑色色素クロロフィルなどが有名。
(b)補酵素F430: 金属-テトラピロール補因子群の1つであり、ニッケルを中心金属とし、メタン生成古細菌、嫌気的メタン酸化古細菌のメタン代謝系酵素Methyl-coenzyme M reductaseの活性部位に利用される。
(c)II型キラターゼ: 金属-テトラピロール補因子群の生合成反応系において、テトラピロールに金属イオンを挿入することで金属-テトラピロール錯体を作る「キラターゼ」酵素のうち、ATPを用いず、キラターゼ機能のみを持つ酵素群。他にI型キラターゼ(ATP依存型キラターゼ)、III型キラターゼ(ATP非依存かつキラターゼ活性以外の他の触媒能も有するキラターゼ)も存在する。
研究成果をわかりやすくご紹介
酵素の仕組みを解明し、新たに非天然型ニッケル補酵素を作ることに成功!
「なぜ、そして、どのように、基本的には有機物からなる生命が、無機物である遷移金属を必須元素として利用するようになったか?」は、元素の観点から生命の成り立ちを考える本質的な問いであり、生命の起源や進化多様性の理解に重要となります。
今回、金属を含む補因子の1つである「金属-テトラピロール」及びその生合成酵素「キラターゼ」の"分子"進化と多様性獲得の理解に向けた第一歩として、キラターゼの最も祖先型であるCfbAに注目し、そのテトラピロール型の基質選別の仕組みを調べました。その結果、互いに非常に似た化学構造のテトラピロール(UPIII、UPI)でも、それぞれCfbAへの結合の仕方が異なり(図1)、基質選別にはたった1つのアミノ酸残基(=11番目のセリン:Ser11)で十分に可能であることを見出しました。さらにこのSer11を別のアミノ酸であるトレオニン(Thr)に置換した人工変異型酵素は、非天然のテトラピロールであるCPIを基質とした、ニッケル-CPI錯体型の人工補酵素の合成に利用できることを見出しました。
社会に与える影響とその可能性
"祖先型"キラターゼであるCfbAの基質選別の仕組みがわかったことにより、「CfbAとは別の"子孫型"キラターゼは、祖先型からどのように進化の過程で生じて、CfbAとは違うテトラピロールを利用するようになったか?」の検証が可能となります。
また、CfbAが合成可能なニッケル-テトラピロールは、人工光合成系の構築に必要不可欠な水素発生触媒として有望とされており、今後、CfbAを触媒として利用した種々の人工ニッケル-テトラピロール化合物の合成も検討していきたいと考えています。

