硫黄運搬タンパク質SufU中の亜鉛-超硫黄システイン錯体構造を発見!「SufUの亜鉛上でのシステインペルスルフィド種の安定化と硫黄運搬の仕組み」(大学院理工学研究科 藤城貴史教授)
2024/10/11
- プレスリリース全文はこちらからご覧ください。
概要
埼玉大学大学院理工学研究科の藤城貴史教授の研究グループは、鉄硫黄クラスター生合成を行うSufCDSUB系において無機硫黄の運搬を担う「亜鉛含有タンパク質SufU」が、その亜鉛と、外部からの無機硫黄によって作られた超硫黄分子"システインペルスルフィド"種との金属錯体を形成することで、無機硫黄を安定に運搬する仕組みを明らかとしました。
本研究により、近年注目を集める超硫黄分子"システインペルスルフィド”の生体内での役割、特に生体内金属イオンや金属タンパク質に対する反応性の理解が進むことが期待されます。
本成果は、アメリカ化学会が発行する無機化学分野の国際誌『Inorganic Chemistry』に、オンライン速報(ASAP)として公開されました。
(URL: https://pubs.acs.org/doi/10.1021/acs.inorgchem.4c02654)
ポイント
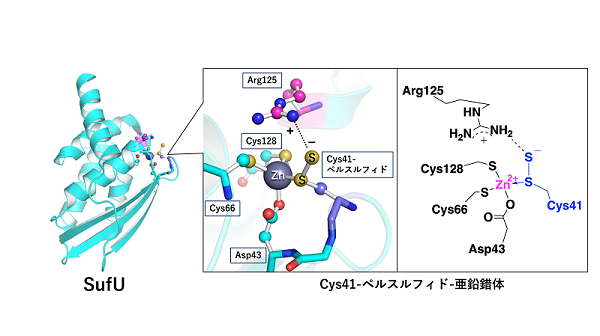
- 硫黄運搬タンパク質SufUは、硫黄運搬時にタンパク質内部にシステインペルスルフィド亜鉛錯体構造を取ることを明らかにした(図1)。
- SufUの亜鉛に結合していた41番目のシステイン残基が、パートナータンパク質SufSから硫黄を受け取ったのち、超硫黄分子(a)の1つとして知られるシステインペルスルフィド(Cys-S-SH)の状態となっていた。
- Cys-S-SHは、一般的にはその末端SHが、負電荷を帯びてCys-S-S-となることで、正電荷を持つ金属イオンと安定な結合をするのに対して、SufUの場合には、Cys-S-SHの内部のSが、亜鉛イオンと化学結合を形成するユニークな構造をとっていた。
- このユニークな構造は、さらに亜鉛近傍の125番目のアルギニンによって安定化されており、その結果として、SufUはCys-S-SHの形で無機硫黄を安定に保持・運搬可能となっていることを突き止めた。
論文情報
| 掲載誌 | Inorganic Chemistry |
|---|---|
| 論文名 | Cysteine-Persulfide Sulfane Sulfur-Ligated Zn Complex of Sulfur-Carrying SufU in the SufCDSUB System for Fe-S Cluster Biosynthesis |
| 著者名 | Takuya Terahata, Yukino Shimada, Chisato Maki, Suguru Muroga, Rina Sakurai, Kouhei Kunichika, Takashi Fujishiro |
| DOI | 10.1021/acs.inorgchem.4c02654 |
| URL | https://pubs.acs.org/doi/10.1021/acs.inorgchem.4c02654 |
用語解説
(a) 超硫黄分子: 硫黄(S)が化学結合で連結した構造(例:-S-S-など)を持ち、ユニークな化学反応性や、様々な生理活性、抗酸化活性、酸化還元シグナル制御などが明らかにされている。
研究成果をわかりやすくご紹介
体内で硫黄を運ぶ仕組みとは?
抗酸化物質システインペルスルフィドの安定化メカニズムを解明
生物にとって、硫黄は必須元素であり、体の中で適切に運用されなければなりません。今回、硫黄(S)がS-Sのように連なった構造を持ち、様々な生命活動で重要とされるアミノ酸「システインペルスルフィド」が、体の中での"硫黄の運搬"にも重要となることを、タンパク質SufUの亜鉛(Zn)–システインペルスルフィド複合体で発見しました。
社会に与える影響とその可能性
抗酸化物質として有望なアミノ酸「システインペルスルフィド」を、安定な物質として社会に供給し、利用するには、その安定化や反応性の理解が必要不可欠です。
本研究は、システインペルスルフィドを安定化し、製品化する際などに重要となる、システインペルスルフィド含有金属化合物の開発に、重要な設計指針を与えうるものです。

