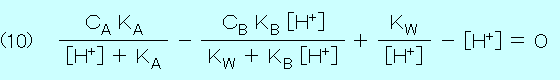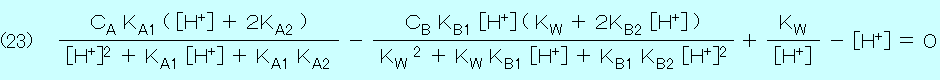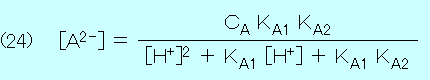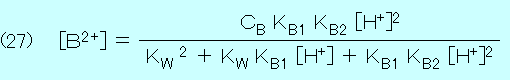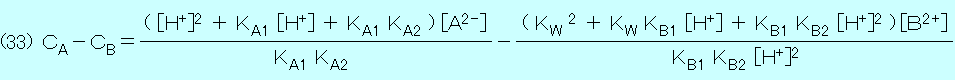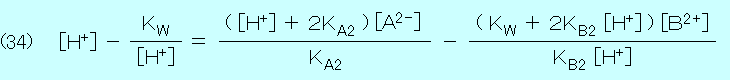濃度とpH曲線の計算方法
○ 酸と塩基の初濃度
混合前の薄い酸の初濃度と体積を CAO (mol/L) と VAO (L) とし,薄い塩基の初濃度と体積を CBO (mol/L) と VBO (L) とする.混合後の体積 V (L) は
(1) V = VAO + VBO
混合直後で中和反応や沈殿反応がまだ起こっていないと仮定したときの仮想的な酸の初濃度 CA (mol/L) と 塩基の初濃度 CB (mol/L) は
(2) CA = CAO VAO / V , (3) CB = CBO VBO / V
○ 水の電離反応とイオン積
水の電離反応より,水のイオン積 KW (mol/L)2 は
H2O ⇔ H+ + OH- , (4) KW = [H+] [OH-] = 1.0×10-14 (mol/L)2 at 25℃
○ 1価の酸 HA と1価の塩基 BOH を組み合わせたときの計算方法
酸 HA の電離反応より,酸の電離定数 KA は
HA ⇔ H+ + A- , (5) KA = [H+] [A-] / [HA]
同様に塩基 BOH の電離反応より,塩基の電離定数 KB は
BOH ⇔ B+ + OH- , (6) KB = [B+] [OH-] / [BOH]
電気的中性より,混合液中の正電荷の総数(濃度)と負電荷の総数(濃度)は等しい.
(7) [H+] + [B+] = [OH-] + [A-]
混合液中で A は分子 HA かイオン A- のどちらかの状態で存在するので,それらの濃度の和は初濃度 CA に等しい.
(8) CA = [HA] + [A-]
同様に混合液中で B は分子 BOH かイオン B+ のどちらかの状態で存在するので,それらの濃度の和は初濃度 CB に等しい.
(9) CB = [BOH] + [B+]
以上の式(1)〜式(9)を連立させて,水素イオン濃度 [H+] を求めると
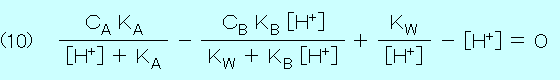
上の式(10)は強酸〜弱酸と強塩基〜弱塩基の全ての組み合わせについて使用できる.[H+] の4次式なので,Java Applet プログラムで [H+] の値を少しずつ変化させて試行錯誤に計算し,式(10)が成立するときの [H+] を求める.さらに,求めた [H+] より水素イオン指数 pH は
(11) pH = - log [H+]
[H+] の値が求まったら,その他の化学種の濃度も計算できる.
(12) [A-] = CA KA / ( [H+] + KA ) , (13) [HA] = [H+] [A-] / KA
(14) [B+] = CB KB [H+] / ( KW + KB [H+] ) , (15) [BOH] = KW [B+] / ( KB [H+] )
○ 2価または1価の酸と2価または1価の塩基を組み合わせたときの計算方法(沈殿しない場合)
2価の酸 H2A の電離反応より,酸の電離定数 KA1 と KA2 は
H2A ⇔ H+ + HA- , (16) KA1 = [H+] [HA-] / [H2A]
HA- ⇔ H+ + A2- , (17) KA2 = [H+] [A2-] / [HA-]
同様に2価の塩基 BOH の電離反応より,塩基の電離定数 KB1 と KB2 は
B(OH)2 ⇔ BOH+ + OH- , (18) KB1 = [BOH+] [OH-] / [B(OH)2]
BOH+ ⇔ B2+ + OH- , (19) KB2 = [B2+] [OH-] / [BOH+]
電気的中性より,混合液中の正電荷の総数と負電荷の総数は等しい.
(20) [H+] + [BOH+] + 2[B2+] = [OH-] + [HA-] + 2[A2-]
混合液中で A は分子 H2A かイオン HA- と A2- のどれかの状態で存在するので,それらの濃度の和は初濃度 CA に等しい.
(21) CA = [H2A] + [HA-] + [A2-]
同様に混合液中で B は分子 B(OH)2 かイオン BOH+ と B2+ のどれかの状態で存在するので,それらの濃度の和は初濃度 CB に等しい.
(22) CB = [B(OH)2] + [BOH+] + [B2+]
以上の式(1)〜式(4)および式(16)〜式(22)を連立させて,水素イオン濃度 [H+] を求めると
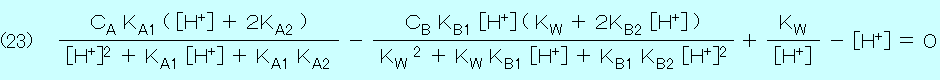
式(10)と同様に,式(23)は2価または1価の強酸〜弱酸と2価または1価の強塩基〜弱塩基の全ての組み合わせについて使用できるので,プログラムで
[H+] の値を少しずつ変化させて試行錯誤に計算し,式(23)が成立するときの [H+] を求める.[H+] の値が求まったら,その他の化学種の濃度も計算できる.
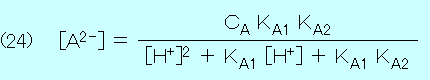
(25) [HA-] = [H+] [A2-] / KA2 , (26) [H2A] = [H+] [HA-] / KA1
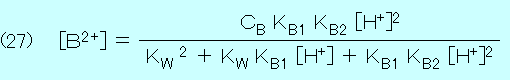
(28) [BOH+] = KW [B2+] / ( KB2 [H+] ) , (29) [B(OH)2] = KW [BOH+] / ( KB1 [H+] )
なお,1価の酸を使用する場合には KA1 = KA , KA2 = 0 を式(23)に代入して [H+] を求め,それを式(12),式(13)に代入して他の化学種の濃度を求める.同様に,1価の塩基を使用する場合には KB1 = KB , KB2 = 0 を式(23)に代入して [H+] を求め,それを式(14),式(15)に代入して他の化学種の濃度を求める.
○ 2価の酸と2価の塩基を組み合わせたときの計算方法(沈殿する場合)
沈殿が生じる場合にも式(16)〜式(20)はそのまま使用できる.沈殿 BA の溶解度積 KSP は
B2+ + A2- → BA↓ , (30) KSP = [B2+] [A2-]
混合液中で A は分子 H2A かイオン HA- と A2- または沈殿 BA のどれかの状態で存在するので,それらの濃度の和は初濃度 CA に等しい.式(21)に見かけの沈殿濃度 [BA] を追加して
(31) CA = [H2A] + [HA-] + [A2-] + [BA]
同様に混合液中で B は分子 B(OH)2 かイオン BOH+ と B2+ または沈殿 BA のどれかの状態で存在するので,それらの濃度の和は初濃度 CB に等しい.式(22)に見かけの沈殿濃度 [BA] を追加して
(32) CB = [B(OH)2] + [BOH+] + [B2+] + [BA]
水素イオン濃度 [H+] を求めるときは Java Applet プログラムの暴走を防ぐために,最初に沈殿しないと仮定して上の式(23)を使用する.得られた [H+] を式(24)と式(27)に代入し,[A2-] と [B2+] の値を求める.次に,それらを式(30)に代入して KSP ≧ [B2+] [A2-] ならば沈殿を生じないので,[H+] ,[A2-] と [B2+] の値をそのまま使用できる.しかし,KSP < [B2+] [A2-] ならば沈殿を生じるので,式(23)を使用して得られた [H+] を初期値として,[H+] ,[A2-] と [B2+] を求めなおす必要がある.式(31)から式(32)を引き,式(16)〜式(19)を代入すると,
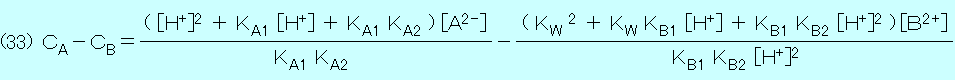
同様に,式(20)に式(16)〜式(19)を代入すると,
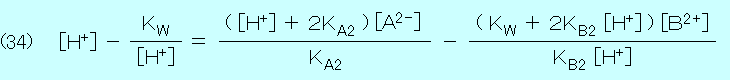
式(33)と式(34)を連立させて,
(35) [A2-] = (WY−VZ)/(UY−VX) , (36) [B2+] = (WX−UZ)/(UY−VX)
U ≡ ( [H+]2 + KA1 [H+] + KA1 KA2 ) / ( KA1 KA2 )
V ≡ ( KW 2 + KW KB1 [H+] + KB1 KB2 [H+]2 ) / ( KB1 KB2 [H+]2 )
W ≡ CA − CB , X ≡ ( [H+] + 2KA2 ) / KA2
Y ≡ ( KW + 2KB2 [H+] ) / ( KB2 [H+] ) , Z ≡ [H+] − KW / [H+]
式(30),式(35),式(36)より
(37) KSP − [B2+] [A2-] = 0
式(37)は沈殿が生じる場合に使用できるので,プログラムで [H+] の値を少しずつ変化させて試行錯誤に計算し,式(37)が成立するときの [H+] ,[A2-] と [B2+] を求める.[H+] 等の値が求まったら,その他の化学種の濃度は式(25),式(26),式(28),式(29)から計算できる.また,見かけの沈殿濃度 [BA]
は式(31)または式(32)より
(38) [BA] = CA − [H2A] − [HA-] − [A2-] = CB − [B(OH)2] − [BOH+] − [B2+]